日前,国家药监局医疗器械技术审评中心公布了《重组胶原蛋白创面敷料注册审查指导原则》、《重组人源化胶原蛋白原材料评价指导原则》(以下简称《评价原则》)2项医疗器械产品注册审查指导原则,以进一步规范重组胶原蛋白创面敷料等医疗器械的管理。
“重组人源化胶原蛋白终于有了统一的评价方法和标准,市场正规化的发展指日可待。”有资深行业人士如是表示。
重组人源化胶原蛋白有了评价标准!
近年来,重组胶原蛋白作为一种由合成生物技术所制成的新型生物材料,因在医美、医疗器械等领域拥有良好的应用场景,而备受化妆品行业、资本市场、消费者的关注。据数据显示,2022年中国重组胶原蛋白市场规模为185亿元,同比增长71.3%,预计到2027年重组胶原蛋白市场规模将达到1083亿元。分产品看,2022年功效性护肤品占重组胶原蛋白市场规模的43%,医用敷料占44%,预计2023年中重组胶原蛋白功效性护肤品将反超医用敷料达到142.5亿元。
随着市场的火热,入局重组胶原蛋白的企业日渐增多,也出现了如产品命名混乱、功效虚假宣传等乱象。有不少从业者曾公开呼吁相关部门尽早介入,持续更新行业标准,从而更好地规范重组胶原蛋白行业的发展。
截自国家药监局医疗器械技术审评中心
为了确保重组人源化胶原蛋白原材料质量可控,国家药监局在近日出台的《评价原则》中表示,“重组人源化胶原蛋白应参考相关行业标准进行必要的分析。”
具体来讲,《评价原则》指出,企业可采用不同的分析方法对材料的分子量、等电点、氨基酸序列、各种翻译后修饰(如脱酰胺化、氧化、糖谱/糖基化修饰、脯氨酸羟基化等)进行充分鉴定,并进行适当的检测,提供相应的检测报告,以确认终产物具有拟宣称的原材料构象、聚集状态、降解状态及胶原蛋白高级结构。
有头部重组胶原蛋白企业研发负责人曾告诉青眼,在重组人源化胶原蛋白研究过程中,企业面临的主要挑战是如何形成正确的“三螺旋”结构。而青眼了解到,目前三螺旋结构的重组胶原蛋白在技术上还很难实现量产,部分企业声称其使用的产品具有三螺旋结构,但无法拿出理论依据和证明,存在虚假宣传的风险。
值得一提的是,《评价原则》详细解析了重组人源化胶原蛋白三螺旋结构分析的方式。《评价原则》指出,企业“可采用圆二色谱在特定常规试验条件下的检测重组人源化胶原蛋白的CD光谱特征。同时,还可采用X射线晶体学技术或冷冻电镜技术在原子结构水平考证胶原蛋白材料或其包含的特定氨基酸序列的三螺旋结构特性,计算有结构信息的序列占整个蛋白序列的百分比……”
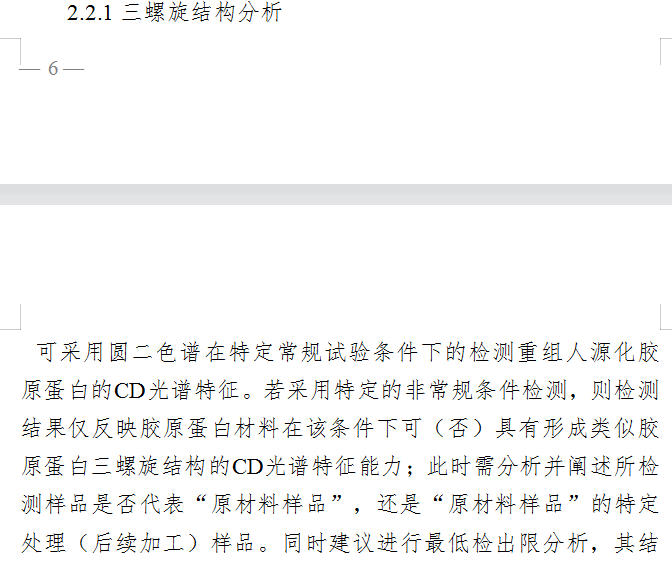
截自《重组人源化胶原蛋白原材料评价指导原则》
此外,《评价原则》还指出,重组人源化胶原蛋白在涉及生物学功能评价时,企业可通过评价细胞-胶原蛋白相互作用来评价重组人源化胶原蛋白的生物学功能,对细胞增殖、分化、黏附性、迁移或移行进行检测。
而在重组人源化胶原蛋白作为制备医疗器械产品的原材料时,《评价原则》表示,企业需要对致敏性、皮肤刺激性、材料介导的致热性等风险进行判定;若重组人源化胶原蛋白生产过程中间体涉及到贮存,则需开展相应的稳定性研究。在研究中,还需对能够反映质量变化的敏感特征进行研究,如含量、完整性、纯度、微生物安全性和生物学特性等。
值得一提的是,《评价原则》还强调,该文件是对医疗器械用重组人源化胶原蛋白原材料的一般要求,适用于人胶原蛋白的所有型别。
但重组人源化胶原蛋白仅是重组胶原蛋白的一类,材料特性并不能完全决定最终产品的安全性和有效性。因此,《评价原则》的内容不直接涉及重组人源化胶原蛋白原材料制成的医疗器械终产品的安全性或有效性评价。
总的来看,除了对不同结构的重组人源化胶原蛋白提出鉴定方法和检测手段外,《评价原则》同样对该原料的纯度判定、含量检测、杂质/污染物和添加剂、热稳定性等理化指标提出了相应的检测方法。且规定企业需要不同的预期用途及使用部位、不同生产工艺、预期使用效果和最终医疗器械的状态,选择适用的指标。
终止命名混乱、虚假宣传乱象
而与《评价原则》同步发布的,还有《重组胶原蛋白创面敷料注册审查指导原则》(以下简称《注册审查原则》)。
青眼发现,不同于《评价原则》的普适性,《注册审查原则》的适用范围更加聚焦,主要是针对第二类医疗器械管理的重组胶原蛋白创面敷料,其结构组成中含有重组胶原蛋白成分(不包括动物组织提取的胶原蛋白成分),用于非慢性创面及其周围皮肤的护理。
具体而言,《注册审查原则》列出了第二类医疗器械管理的重组胶原蛋白创面敷料注册审查的要点,主要包括对产品名称、管理类别/分类编码、注册单元划分的原则和实例、结构及组成、产品技术要求等信息进行规范化管理。
比如,《注册审查原则》着重指出,产品名称应符合《医疗器械通用名称命名规则》等相关法规、规范性文件的要求。产品名称的材料部分统一为“重组胶原蛋白”,如重组胶原蛋白凝胶敷料、重组胶原蛋白创面敷贴等。除非有充分资料证明重组胶原蛋白原材料的结构特征等能够给申报产品功能带来额外获益,产品名称不区分具体材料特征。
《注册审查原则》同时强调,产品所含成分可能涉及很多种类,但所含成分不应具有药理学作用,不可被人体吸收。产品结构及组成原则上不体现重组胶原蛋白原材料的结构特征、氨基酸序列等相关信息(除非有充分资料证明重组胶原蛋白原材料的结构特征等能够给申报产品功能带来额外获益)。
确如上文所言,命名混乱、混淆结构特征的虚假宣传是当前重组胶原蛋白市场的两大乱象。而《注册审查指导原则》颁布,将上述乱象作为审查重点,并提供了针对性的解决方案,这无不体现出国家层面对重组胶原蛋白市场的高度关注。
重组胶原蛋白市场或迎变局
针对此次国家药监局发布的2项医疗器械产品注册审查指导原则,有资深行业人士认为,“以锦波生物、巨子生物等为代表的头部重组胶原蛋白企业必然会积极响应。从他们的业务布局看,这不仅会影响到医疗器械领域,后续对重组胶原蛋白化妆品的配方、工艺研究的影响也是必然的。”
事实上,这并非国家药监局首次发布重组胶原蛋白的指导规范。
比如为解决行业存在的不规范用语现象,2021年,国家药监局就发布了《重组胶原蛋白生物材料命名指导原则》。据规定内容,重组胶原蛋白生物材料名称应由A和B两部分构成,应分别在A和B项下选择一个与之吻合的术语作为核心词(A+B),核心词不可缺省。
其中,A项核心词只有3个,包括“重组人胶原蛋白”“重组人源化胶原蛋白”“重组类胶原蛋白”。“类人胶原蛋白”名称不在其列。B项核心词包括:溶液、冻干粉、凝胶、海绵、纤维、其他。
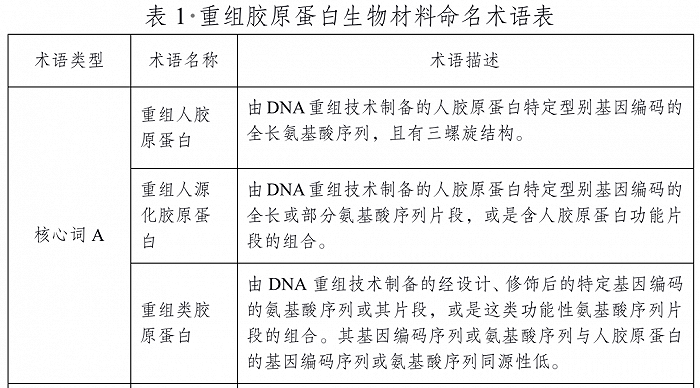
截自《重组胶原蛋白生物材料命名指导原则》
2022年8月,YY/T 1849-2022《重组胶原蛋白》行业标准正式实施,规定了重组胶原蛋白的质量控制要求、检测指标及其检测方法等,适用于作为医疗器械原材料的重组胶原蛋白的质量控制。据悉,这也是国家首次针对重组胶原蛋白在医药领域出台的行业标准。
不可否认的是,行业最新标准发布将拉开不同技术层级的原料布局,“两个指导原则的发布,意味着重组胶原蛋白、重组人源化胶原蛋白有了统一的审查、评价标准,这对行业的规范化发展有着重要的意义。随着标准的统一,重组胶原蛋白产业格局必将迎来新的变化。”今日,不少行业人士如是向青眼感叹道。
可以看到,从对重组胶原蛋白生物材料的命名、行业标准的建立,再到重组人源化胶原蛋白评价指导原则和重组胶原蛋白创面敷料注册审查指导原则的颁布,国家层面对重组胶原蛋白市场的监管正从全面规范走到精细化管理。而这,也是一个新兴领域从爆发式增长到高质量、规范化发展的必由之路。
